idż do fizyka kwantowa. 2. Definicja i własności temperatury bezwzględnej; temperatura układów w równowadze cieplnej; pomiar temperatury. 3. Entropia (definicja mikroskopowa, małe przekazy ciepła); stan równowagi. 4. Układ kontaktujący się termicznie ze zbiornikiem ciepła (rozkład kanoniczny). 5. Paramagnetyzm (prawo Curie). Ciepło właściwe oscylatora harmonicznego. 6. Średnia energia i średnie ciśnienie gazu doskonałego. 7. Twierdzenie o wiriale w zastosowaniu do gazu doskonałego. Gazy rzeczywiste. 8. Ogólne równanie stanu gazów doskonałych. 9. Twierdzenie o ekwipartycji energii (wyprowadzenie i przykłady). 10. Maxwellowski rozkład prędkości. 11. Entropia gazu doskonałego; równanie adiabaty. 12. Zasady termodynamiki i związki statystyczne. Sprawność silnika. Cykl Carnota. 13. Potencjały termodynamiczne (wyprowadzenia) i tożsamości Maxwella. 14. Prawo Steana-Boltzmana. Prawo Wina. 15. Stan równowagi pomiędzy fazami; równanie Clausiusa - Clapeyrona. 16. Układy otwarte. Statystyki kwantowe. Granica klasyczna. 17. Rozkład Plancka. 18. Gęstość stanów w przestrzeniach 1, 2, 3-wymiarowych. Periodyczne a sztywne warunki brzegowe. 19. Gaz elektronów swobodnych. 20. Półprzewodniki: gęstość nośników, prawo działania mas, potencjał chemiczny. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 3. Entropia (definicja mikroskopowa, małe przekazy ciepła); stan równowagi.Entropia układu jest logarytmiczną miarą liczby stanów dozwolonych danego układu:
Entropia stanowi miarę logarytmiczną stopnia przypadkowości (nieuporządkowania) układu. Małe przekazy ciepła.
Układ A' zostaje termicznie skontaktowany z innym układem i pobiera pewną ilość ciepła Q tak małą, że |Q|<<
 -E0, czyli -E0, czyli
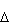 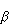 |<< |<<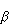 , to znaczy, gdy Q jest dostatecznie małe, by temperatura układu praktycznie nie uległa
zmianie. Jeżeli układ pobiera tak małe ilości ciepła, to wówczas energia początkowa i energia końcowa będą z ogromnym prawdopodobieństwem równe swoim średnim wartościom , to znaczy, gdy Q jest dostatecznie małe, by temperatura układu praktycznie nie uległa
zmianie. Jeżeli układ pobiera tak małe ilości ciepła, to wówczas energia początkowa i energia końcowa będą z ogromnym prawdopodobieństwem równe swoim średnim wartościom
 i i  +Q.
W czasie pobierania ciepła przez układ A zmienia się liczba dozwolonych stanów układu +Q.
W czasie pobierania ciepła przez układ A zmienia się liczba dozwolonych stanów układu 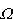 (E). Korzystając z rozwinięcia w szereg Taylora: (E). Korzystając z rozwinięcia w szereg Taylora:
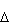 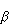 << <<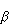 . Zatem zmiana logarytmu liczby stanów . Zatem zmiana logarytmu liczby stanów 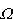 wyrazi się wzorem:
wyrazi się wzorem:
Jeśli ilość pobranego ciepła (DQ) jest rzeczywiście nieskończenie mała, to przyrost entropii możemy zapisać w postaci
Stan równowagi.O układzie wielu cząstek, którego stan makroskopowy nie dąży do zmiany w czasie, mówimy, że jest w stanie równowagi. Obserwuje się, że układy znajdujące się w pewnym szczególnym stanie, znacznie różnym od średniej wartości w stanie równowagi, dążyć będą zawsze do wartości średniej. Czas potrzebny do zaniku takiej fluktuacji i powrotu do stanu równowagi nazywamy czasem relaksacji. Ponieważ wszystkie możliwe sposoby ruchu cząstek układu prowadzą do stanu mniej uporządkowanego, więc układ będzie dążył do takiego stanu, w którym byłby on jak najmniej uporządkowany. Po osiągnięciu takiej najmniej uporządkowanej sytuacji układ nie będzie wykazywał tendencji do zmiany w czasie, co oznacza, że znajdzie się w stanie równowagi.Własności stanu równowagi:
Ze stanami równowagi wiąże się termin nieodwracalności. Proces nazywamy nieodwracalnym, jeżeli po odwróceniu biegu czasu przebiegałby w sposób nie obserwowany w rzeczywistości prawie nigdy. góra |
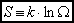
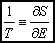
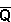 układu A jest bardzo mała w porównaniu z nadwyżką średniej energii
układu A jest bardzo mała w porównaniu z nadwyżką średniej energii 
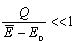 ,
, 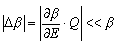
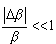 ,
, 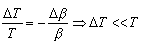
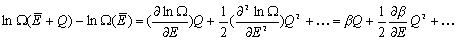
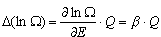

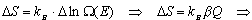
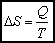 ,
,