idż do fizyka statystyczna. 2. Teoria Bohra układów wodoropodobnych.Doświadczenie Francka-Hertza. 3. Zjawisko fotoelektryczne. Wytwarzanie promieniowania rentgenowskiego. 4. Zjawisko Comptona. 5. Oddziaływanie promieniowania elektromagnetycznego z materią. 6. Fale de Broglie'a (własności, omówienie doświadczeń). 7. Postulaty fizyczne mechaniki kwantowej. Równanie Kleina - Gordona. 8. Mechanika falowa Schrödingera (operatory, postulaty). 9. Skok potencjału. Bariera potencjału. Zjawisko tunelowania. 10. Stany związane - nieskończona studnia potencjału. 11. Funkcje własne operatora pędu. Zasada nieoznaczoności. 12. Operator momentu pędu. 13. Równanie Schrödingera dla atomu wodoru; liczby kwantowe. Widma metali alkalicznych. 14. Orbitalny magnetyczny moment dipolowy. Precesja Larmora. 15. Oddziaływanie spin-orbita; sprzężenie L-S, j-j 16. Efekt Zeemana. Efekt Starka. 17. Konfiguracje elektronów w atomie. Reguły Hunda. 18. Liniowe widmo rentgenowskie. Prawo Moseley'a. Szerokość linii widmowej. 19. Atomy wieloelektronowe (helopodobne). Układ okresowy pierwiastków. 20. Molekuły dwuatomowe. Wiązania cząsteczkowe. Hybrydyzacja. |
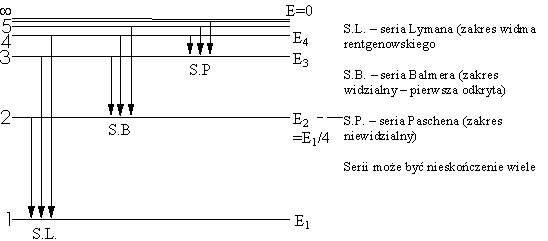
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 2. Teoria Bohra układów wodoropodobnych.Doświadczenie Francka-Hertza.Jednocześnie z doskonaleniem się techniki pomiarowej czynione były liczne próby znalezienia praw rządzących rozkładem linii w obserwowanych widmach. Bardzo wcześnie zauważono, że widma niektórych pierwiastków zawierają setki linii, podczas gdy widma innych są stosunkowo ubogie. Szczególne zainteresowanie budziło widmo wodorowe; w 1885 r. Balmer podał wzór empiryczny opisujący to widmo. Wykazał on, że długość fali każdej z tych linii wodorowych może być z dużą dokładnością przedstawiona prostym wzorem:
W miarę odkrywania nowych linii w widmie wodoru stawało się jasne, że zawiera ono więcej niż jedną serię widmową. Następnego kroku naprzód w badaniu prawidłowości w widmie wodorowym dokonał Rydberg, który wykazał, że liczba falowa każdej linii w dowolnej serii tego widma daje się przedstawić ogólnym wzorem:
gdzie Termy. Zasada kombinacji Rydberga - Ritza.Z ogólnego wzoru Rydberga widać, że każda linia spektralna atomu wodoru daje się przedstawić jako różnica dwu wyrazów postaci R/n2, które nazwano termami (Tn): Tn
= R/n2
gdzie n = 1, 2, 3, ...
Także w widmach innych pierwiastków, mimo ich bardziej
skomplikowanej struktury, można wydzielić serie podobne do
wodorowych. A więc i wówczas liczba falowa każdej linii spektralnej
da się przedstawić w postaci różnicy dwóch termów: 1/
Jednak w porównaniu z
termami wodorowymi postać matematyczna termów innych pierwiastków
jest na ogół bardziej skomplikowana.Analizując dokładniej linie należące do różnych serii widmowych Ritz (1908r) sformułował zasadę, która znana jest pod nazwą zasady kombinacji Rydberga - Ritza: Liczby falowe dowolnych linii spektralnych mogą być wyrażone jako różnice odpowiednich termów, które z kolei przez kombincję z innymi termami służyć mogą do obliczania liczb falowych innych linii tego samego widma. W ten sposób analizę dużej na ogół liczby linii spektralnych sprowadzić można do znacznie mniejszej liczby termów. Zasada kombinacji Rydberga - Ritza ma zupełnie ogólny charakter mimo, że jest ona ograniczona przez tzw. reguły wyboru. Zasada ta odegrała podstawową rolę przy formułowaniu teorii widm atomowych i budowy atomu. Budowa atomu.Istniało już wiele dowodów eksperymentalnych na to, że atomy zawierają elektrony (na przykład rozproszenie promieniowania rentgenowskiego na atomach, zjawisko fotoelektryczne). Fakt, że masa elektronu jest bardzo mała w porównaniu z masą najlżejszego nawet atomu oznacza, iż prawie cała jego masa musi być związana z ładunkiem dodatnim. Wszystkie rozważania w oczywisty sposób prowadziły do pytania, jak wygląda rozkład dodatnich i ujemnych ładunków wewnątrz atomu. Thomson zaproponował model budowy atomu, zgodnie z którym ujemnie naładowane elektrony znajdują się wewnątrz pewnego obszaru, w którym w sposób ciągły rozłożony jest ładunek dodatni. Zakładał przy tym, że obszar wypełniony ładunkiem dodatnim ma symetrię kulistą. Model ten okazał się chybiony, a
ostateczny dowód na nieadekwatność modelu atomu Thomsona dostarczył w
1911 r. Ernest Rutherford. Z doświadczeń nad rozpraszaniem cząstek Główny jednak zarzut, jaki można postawić modelowi Rutherforda, w którym elektrony podlegają prawom elektrodynamiki klasycznej, jest jego zupełna nietrwałość. Atom taki zaraz po powstaniu przestałby istnieć wskutek spadku elektronu na jądro. Aby przezwyciężyć te trudności,
Bohr zaproponował w 1913 roku przyjęcie modelu atomu Rutherforda z
dodaniem postulatów:
postulat iii. Zasada częstości. Przy przechodzeniu atomu z jednego stanu stacjonarnego do innego zostaje wyemitowany lub pochłonięty kwant energii. Gdy elektron przeskakuje z toru stacjonarnego o większej energii E2 na tor stacjonarny o mniejszej energii E1, wysyła foton o energii
Przejściom takim towarzyszy zmiana orbity z r1 na r2 lub odwrotnie. W związku z tym mówi się obrazowo, że na gruncie teorii Bohra promieniowanie jest wynikiem przeskoku elektronowego. Gdy elektron o masie me i prędkości V krąży po torze kołowym o promieniu r, to jego moment pędu jest dany wzorem:
Jak wiemy z mechaniki klasycznej dla torów kołowych siła oddziaływania elektrostatycznego jest siłą dośrodkową gdzie Ze jest ładunkiem jądra.
Ze związków
tych łatwo obliczyć różne wielkości odnoszące się do stacjonarnych
orbit kołowych: rn, Vn, En,
Okazało się, że teoria ta wystarczająco dobrze opisywała model atomów wodoropodobnych, w tym odkryte serie widmowe wodoru.
W 1922 r. Bohr dostał nagrodę Nobla za budowę i opis atomu wodoru. Z punktu widzenia współczesnej mechaniki kwantowej teoria Bohra jest błędna. Ponadto nie można jej rozszerzyć na atomy wieloelektronowe. Ale niewątpliwie przyczyniła się do bliższego poznania struktury atomu, a najważniejsze - wprowadziła skwantowanie poziomów energetycznych. Doświadczenie Francka - Hertza.
W 1914 roku J. Franck i G. Hertz przeprowadzili doświadczenie, które było empirycznym dowodem na istnienie skwantowanych poziomów energetycznych. Schemat doświadczenia przedstawia poniższy rysunek Napięcie siatki to napięcie przyspieszające, natomiast anodowe to napięcie hamujące. Początkowo elektrony są przyspieszane i jeżeli napięcie przyspieszające jest bardzo małe, to napięcie anodowe hamuje elektrony i prąd nie płynie. Zwiększamy napięcie siatki i w pewnym momencie prąd zaczyna płynąć. Dalsze zwiększanie napięcia powoduje wzrost natężenia prądu i właściwie spodziewamy się efektu, że w miarę wzrostu napięcia cały czas rośnie prędkość elektronów. Otóż wynik eksperymentu jest inny, co obrazuje wykres
Widać wyraźnie, że w okolicach wielokrotności 4,86 V elektrony tracą energię. Strata ta jest spowodowana zderzeniami elektronów z atomami rtęci, które właśnie przy takiej energii można wzbudzić. Elektron porusza się dalej, jest cały czas przyspieszany i jeżeli drugi raz jego energia wyniesie 4,86 eV, znowu ma możliwość wzbudzenia atomu rtęci i ponownie maleje jego prędkość, a tym samym wartość płynącego prądu. Proces ten się powtarza przy każdej wielokrotności 4,86 V i obserwuje się wyraźne skoki natężenia płynącego prądu. Energia 4,86 eV odpowiada linii emisyjnej 253,6 nm Wytłumaczenie tego zjawiska musi być oparte na teorii dyskretnych poziomów energetycznych. Aby atomy wzbudzały się tylko przy określonych energiach, poziomy energetyczne muszą być skwantowane, inaczej odbierałyby energię elektronom w sposób ciągły lub mniej uporządkowany. Ten eksperyment święcił swego czasu ogromne sukcesy (nagroda Nobla w 1925 r.), ponieważ przekonywał o skwantowaniu poziomów energetycznych i istnieniu charakterystycznego widma atomowego. Materiał uzupełniający (nadobowiązkowy)Okazało się, że w widmach atomów występują jednak linie, których nie można przyporządkować przejściom pomiędzy poziomami energetycznymi przewidywanymi przez teorię Bohra. Teoria wymagała więc dalszych uogólnień i poszły one w trzech kierunkach:
|