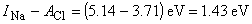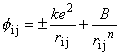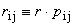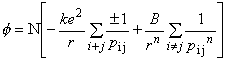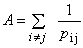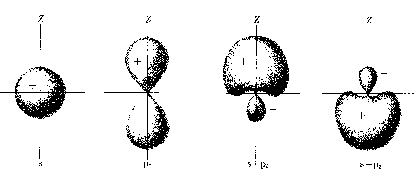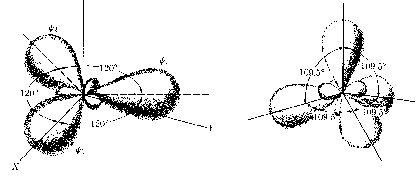idż do fizyka statystyczna. 2. Teoria Bohra układów wodoropodobnych.Doświadczenie Francka-Hertza. 3. Zjawisko fotoelektryczne. Wytwarzanie promieniowania rentgenowskiego. 4. Zjawisko Comptona. 5. Oddziaływanie promieniowania elektromagnetycznego z materią. 6. Fale de Broglie'a (własności, omówienie doświadczeń). 7. Postulaty fizyczne mechaniki kwantowej. Równanie Kleina - Gordona. 8. Mechanika falowa Schrödingera (operatory, postulaty). 9. Skok potencjału. Bariera potencjału. Zjawisko tunelowania. 10. Stany związane - nieskończona studnia potencjału. 11. Funkcje własne operatora pędu. Zasada nieoznaczoności. 12. Operator momentu pędu. 13. Równanie Schrödingera dla atomu wodoru; liczby kwantowe. Widma metali alkalicznych. 14. Orbitalny magnetyczny moment dipolowy. Precesja Larmora. 15. Oddziaływanie spin-orbita; sprzężenie L-S, j-j 16. Efekt Zeemana. Efekt Starka. 17. Konfiguracje elektronów w atomie. Reguły Hunda. 18. Liniowe widmo rentgenowskie. Prawo Moseley'a. Szerokość linii widmowej. 19. Atomy wieloelektronowe (helopodobne). Układ okresowy pierwiastków. 20. Molekuły dwuatomowe. Wiązania cząsteczkowe. Hybrydyzacja. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 20. Molekuły dwuatomowe. Wiązania cząsteczkowe. Hybrydyzacja.Molekuły dwuatomoweNa cząsteczkę możemy spojrzeć jak na stabilną konfigurację grupy jąder i elektronów. Szczegółowe ich ułożenie wyznaczone jest przez siły elektromagnetyczne i prawa mechaniki kwantowej. Takie pojęcie cząsteczki jest naturalnym rozszerzeniem pojęcia atomu. Innym punktem widzenia jest traktowanie cząsteczki jako stabilnej struktury utworzonej przez połączenie dwu lub więcej atomów. W tym podejściu atomy w cząsteczce zachowują swoja tożsamość, podczas gdy w pierwszym podejściu - nie. W ogólności, strukturę i własności cząsteczek najlepiej opisuje kombinacja obu tych podejść. Gdy z dwóch atomów tworzy się cząsteczka, elektrony wewnętrznych powłok każdego z atomów pozostają ściśle związane ze swym jądrem i ich ruch prawie nie jest zakłócony, natomiast najbardziej zewnętrzne, luźno związane elektrony zostają mocno zaburzone, oddziałują na wszystkie cząstki (elektrony i jony) układu. Ich funkcje falowe silnie się zmieniają, gdy atomy zbliżają się do siebie. To właśnie oddziaływanie prowadzi do wiązania, tj. zmniejszania energii całkowitej, gdy jądra czy jony są blisko siebie. Oddziaływanie to, odpowiedzialne za występowanie sił międzyatomowych ma naturę elektromagnetyczną. Utworzona cząsteczka musi być trwalsza niż poszczególne atomy, w przeciwnym bowiem przypadku nie doszłoby do jej powstania. Proces powstawania cząsteczki musi być korzystny energetycznie, czyli musi prowadzić do zmniejszenia energii układu. W tworzeniu wiązań i związków uczestniczą elektrony zewnętrznej powłoki elektronowej atomu (walencyjne), przy czym cząsteczki powstają jedynie wówczas, gdy w wyniku reakcji każdy atom osiąga trwałą konfigurację elektronową. Najtrwalsze konfiguracje elektronowe mają atomy gazów szlachetnych. Gazy te są zbudowane z cząsteczek jednoatomowych, które nie reagują normalnie z żadnymi innymi atomami. Brak reaktywności oznacza maksymalną trwałość tych atomów; nie mogą one osiągać mniejszej energii przez utworzenie związków. Atomy
mogą osiągać trwałą konfigurację elektronową przez oddawanie,
przyłączanie lub uwspólnianie elektronów. Trzy podane typy wiązań to: jonowe, polegające na całkowitym przejściu jednego lub więcej elektronów z jednego atomu na inny, wiązanie kowalencyjne, polegające na uwspólnieniu przez dwa atomy pary elektronów i wiązanie metaliczne, w przypadku którego elektrony mogą przemieszczać się swobodnie w całym krysztale. Rzadko mamy do czynienia z wiązaniami czysto jonowymi, kowalencyjnymi lub metalicznymi. Większość wiązań ma charakter pośredni i wykazuje pewne cechy wszystkich trzech wymienionych typów.
Wiązanie jonowe.Rozpatrzmy tworzenie się cząsteczki NaCl z atomu Na i atomu Cl. By wyrwać elektron z sodu, potrzebna jest energia jonizacji 5.14 eV. Jest to tzw. energia jonizacji INa=5.14eV . Elektron ten uzupełnia powłokę chloru i powstaje jon Cl-, którego energia jest niższa o 3.71 eV od energii atomu Cl. To z kolei jest tzw. powinowactwo elektronowe – uzyskiwana energia, gdy dodatkowy elektron zostaje związany przez neutralny atom (ACl=3.71 eV). Zatem :
Ostatecznie, całkowity zysk energii na utworzenie cząsteczki NaCl jest: (4.51-1.43) eV = 3.08 eV. Energia potencjalna oddziaływania pomiędzy dwoma jonami wynosi:
 10) 10)
r - odległość pomiędzy najbliższymi sąsiadami pi j - bezwymiarowa wielkość zależna od typu struktury Całkowita energia potencjalna:
NaCl (struktura typu B1, sieć FCC): A = 1.748 CsCl (struktura typu B2, podobna do BCC, ale atom centrujący jest innego typu niż atom w narożu): A = 1.763
Mówi się, że cząsteczka jonowa jest cząsteczką polarną. Wiązanie jonowe nazywa się wiązaniem heteropolarnym. Nie ma ono wyróżnionego kierunku, ponieważ każdy jon ma wszystkie powłoki zamknięte, co daje symetrię sferyczną. Związki z przewagą wiązania jonowego są w stanie stałym, zbudowane są z kationów i anionów, przyciągających się ze stosunkowo znaczną siłą. Takie kryształy są twarde oraz mają wysokie temperatury topnienia i wrzenia (rosnące ze wzrostem jonowego charakteru wiązania). Rozpuszczają się na ogół dobrze w rozpuszczalnikach polarnych, których głównym przedstawicielem jest woda. W stanie stopionym lub w roztworze przewodzą prąd elektryczny, jony bowiem mogą stosunkowo swobodnie poruszać się w kierunku elektrod. Reakcje z udziałem związków jonowych zachodzą bardzo szybko. Wiązanie jonowe występuje w związkach pierwiastków z pierwszej kolumny tablicy okresowej z pierwiastkami drugiej od końca kolumny (halogenki metali alkalicznych: KCl, LiBr, itp.), podobnie jak w związkach pierwiastków drugiej kolumny z pierwiastkami kolumny trzeciej od końca (tlenki metali ziem alkalicznych, siarczki, itp.). Typowe
energie wiązań na parę jonów dla kryształów jonowych: Wiązanie kowalencyjne.Wiązanie kowalencyjne jest wynikiem uwspólniena pary elektronowej, przy czym każdy atom dostarcza jeden elektron. Uwspólniona para elektronów wiązania może jednak pochodzić od jednego tylko atomu - powstaje wówczas tzw. wiązanie koordynacyjne, mające identyczne właściwości jak normalne wiązanie kowalencyjne. Mogą powstawać także tzw. wiązania podwójne lub potrójne przez uwspólnienie 4 lub 6 elektronów. Rozpatrzmy teraz tworzenie się cząsteczki H2. Fakt, że cząsteczka H2 istnieje tłumaczy się w mechanice kwantowej zachowaniem się elektronowych funkcji własnych opisujących rozkład ładunku w układzie, gdy dwa atomy wodoru zbliżamy do siebie. Wynikający stąd rozkład ładunku prowadzi do przyciągania elektrostatycznego, ale rozkład ładunku jest taki, że nie sposób wyróżnić, który elektron należy do którego atomu, oba elektrony są jednocześnie wspólne dla obu atomów.
Najlepiej można zrozumieć wiązanie kowalencyjne rozpatrując najpierw
prostszy przypadek H2+, zjonizowanej cząsteczki
wodoru. Energia potencjalna elektronu jest symetryczna względem
płaszczyzny prostopadłej do odcinka łączącego oba jądra i
przechodzącej przez jego środek, gdyż potencjał jest sumą dwóch
takich samych potencjałów kulombowskich scentrowanych na końcach tego
odcinka. Ponieważ dla tego potencjału ruch elektronu w stanie
związanym będzie miał tę samą symetrię, gęstości prawdopodobieństwa
stanów związanych elektronu
Ponieważ
elektron o gęstości prawdopodobieństwa
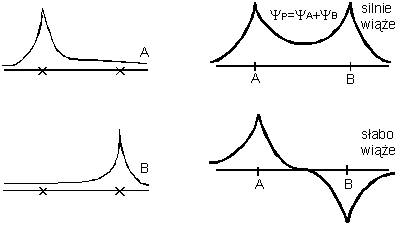
Prawdopodobieństwo znalezienia elektronu, którego zachowanie opisane jest gęstością prawdopodobieństwa dla parzystej funkcji własnej, jest stosunkowo duże w obszarze o najsilniej wiążącym potencjale, tzn. w obszarze rozciągającym się od jednego jądra przez środek cząsteczki do drugiego jądra. A więc elektron taki jest stosunkowo silnie związany.
Rysunek przedstawia sumę energii elektronu i energii odpychania
kulombowskiego jąder dla dwóch najniższych stanów energetycznych
cząsteczki H2+ w funkcji odległości R
między jądrami. Dla bardzo dużych R, elektron przyłączy się do
jednego lub drugiego jądra w najniższym stanie energetycznym atomu
wodoru. Energia odpychania będzie zaniedbywalna i energia całego
układu będzie miała -13.6 eV. Dla stanu kwantowego o parzystej
funkcji własnej, gdy R się zmniejsza, energia początkowo
maleje. Powodem tego jest fakt, że przy zbliżaniu jądra do elektronu
znajdującego się już w pobliżu innego jądra, ujemna energia
oddziaływania elektronu ze zbliżanym jądrem rośnie co do wartości
bezwzględnej szybciej niż dodatnia energia oddziaływania obu jąder
(dopóki odległość między jądrami nie jest zbyt mała, elektron w
stanie o parzystej funkcji własnej dąży do pozostawania pomiędzy nimi
i jego odległość od każdej z jąder jest mniejsza niż odległość
dzieląca jądra). Gdy odległość między jądrami będzie dalej zmniejszać
się, energia układu przejdzie przez minimum i zacznie gwałtownie
wzrastać. Dzieje się tak dlatego, że energia wiązania elektronu,
nawet gdy jądra są bardzo blisko siebie, nie może przyjąć wartości
bardziej ujemnej od -22 Dodajmy teraz drugi elektron. W związku z całkowitym nakładaniem się przestrzennych funkcji falowych nierozróżnialnych elektronów w H2, przypisanie danego elektronu do danego atomu w cząsteczce jest zupełnie niemożliwe. Zamiast tego mówimy o dwóch elektronach, które są odpowiedzialne za wiązanie utrzymujące razem atomy w cząsteczce, że są one w cząsteczce, czy w samym wiązaniu, wspólne. Na tym polega więc koncepcja pary wspólnych elektronów o "antyrównoległych" spinach, które tworzą wiązanie kowalencyjne. Wiązanie kowalencyjne mogą tworzyć najwyżej dwa elektrony. Mówimy, że elektron jednego atomu tworzy parę z elektronem z drugiego atomu. W odróżnieniu od wiązania jonowego, wiązanie kowalencyjne ma wyróżniony kierunek. Rozkład ładunku par elektronów w wiązaniu kowalencyjnym jest symetryczny względem środka cząsteczki. Ponieważ w cząsteczkach zawierających dwie nieidentyczne jądra wiązanie może być częściowo jonowe nawet jeśli zasadniczo jest kowalencyjne, więc tylko takie cząsteczki jak O2 i N2 są ściśle homopolarne. Związki z przewagą wiązania kowalencyjnego (homeopolarnego) są w stanie stałym, zbudowane z cząsteczek, które słabo na siebie oddziałują. Ich kryształy wykazują niewielką odporność na działanie czynników mechanicznych, a temperatury przejść fazowych są niskie. Rozpuszczają się w rozpuszczalnikach niepolarnych (benzen, tetrachlorek węgla,...), a wyjątkowo w polarnych. Stopione lub rozpuszczone nie przewodzą prądu elektrycznego. Związki kowalencyjne reagują zwykle wolno, gdyż warunkiem zajścia reakcji jest często konieczność rozerwania wiązania. Hybrydyzacja.W celu prostego opisania cząsteczki i jej symetrii wprowadza się pojęcie orbitali zhybrydyzowanych. Orbitale zhybrydyzowane to nowy typ orbitali atomowych. Otrzymuje się je przez zmieszanie, czyli hybrydyzację orbitali różnego typu TEGO SAMEGO ATOMU. Istota zagadnienia sprowadza się do tego, że w atomie wieloelektronowym lub w cząsteczce sens fizyczny ma tylko rozkład gęstości ładunku wszystkich elektronów, natomiast podział tego ładunku na poszczególne elektrony jest w pewnym stopniu dowolny. Orbitale zhybrydyzowane mają inny kształt niż orbitale typu s lub p. Orbital zhybrydyzowany skoncentrowany jest głównie po jednej stronie jądra atomowego i dzięki temu ma on silniejsze własności kierunkowe niż orbital typu s lub p.
Mogą być różne typy hybrydyzacji. Najczęściej stosujemy orbitale
zhybrydyzowane utworzone z orbitali s i p. Ogólnie można powiedzieć,
że im większy jest udział orbitalu s w orbitalach zhyprydyzowanych,
tym większe są kąty między nimi:
Rozpatrzmy to zagadnienie na konkretnym przykładzie: cząsteczki
fluorku berylu BeF2. Centralnym atomem tej cząsteczki jest
beryl w stanie podstawowym 1s22s2
Wszystkie wiązania powstające w wyniku czołowego nakładania się
orbitali nazywa się wiązaniami
Wiązanie metaliczneFunkcje
falowe elektronów walencyjnych są rozległe w porównaniu z
odległościami między atomami. Np. dla niklu funkcja 4s ma istotną
amplitudę nawet w połowie odległości do trzecich najbliższych
sąsiadów i dlatego wielu sąsiadów uczestniczy w wiązaniu. W metalach przejściowych elektrony d tworzą rodzaj kowalencyjnej ramy i dają główny wkład do energii wiązania. Wiązanie wodoroweGdy wodór bierze udział w wiązaniu z silnie elektroujemnym atomem, np. tlenem, pojedynczy elektron jest prawie w pełni przeniesiony na ten drugi atom. Tak powstały proton może przyciągać drugi ujemnie naładowany atom. W ten sposób atom wodoru jest podwójnie skoordynowany w wiązaniu wodorowym. Energia wiązania jest rzędu 0,1 eV na wiązanie. Wiązania wodorowe są odpowiedzialne za połączenie dwóch łańcuchów w podwójną helisę cząsteczki DNA (grają podstawową rolę w mechanizmach genetycznej reprodukcji). Woda: każdy atom tlenu w wodzie jest otoczony czterema dalszymi atomami tlenu w konfiguracji tetraedrycznej (wiązanie poprzez atomy wodoru). Wiązanie wodorowe występujące w fazie ciekłej odpowiedzialne jest za anomalną rozszerzalność wody (do 4 C) Wiązanie van der Waalsa
góra |