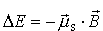idż do fizyka statystyczna. 2. Teoria Bohra układów wodoropodobnych.Doświadczenie Francka-Hertza. 3. Zjawisko fotoelektryczne. Wytwarzanie promieniowania rentgenowskiego. 4. Zjawisko Comptona. 5. Oddziaływanie promieniowania elektromagnetycznego z materią. 6. Fale de Broglie'a (własności, omówienie doświadczeń). 7. Postulaty fizyczne mechaniki kwantowej. Równanie Kleina - Gordona. 8. Mechanika falowa Schrödingera (operatory, postulaty). 9. Skok potencjału. Bariera potencjału. Zjawisko tunelowania. 10. Stany związane - nieskończona studnia potencjału. 11. Funkcje własne operatora pędu. Zasada nieoznaczoności. 12. Operator momentu pędu. 13. Równanie Schrödingera dla atomu wodoru; liczby kwantowe. Widma metali alkalicznych. 14. Orbitalny magnetyczny moment dipolowy. Precesja Larmora. 15. Oddziaływanie spin-orbita; sprzężenie L-S, j-j 16. Efekt Zeemana. Efekt Starka. 17. Konfiguracje elektronów w atomie. Reguły Hunda. 18. Liniowe widmo rentgenowskie. Prawo Moseley'a. Szerokość linii widmowej. 19. Atomy wieloelektronowe (helopodobne). Układ okresowy pierwiastków. 20. Molekuły dwuatomowe. Wiązania cząsteczkowe. Hybrydyzacja. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 15. Oddziaływanie spin-orbita; sprzężenie L-S, j-jFunkcja falowa opisująca stan poszczególnych elektronów atomu wieloelektronowego jest scharakteryzowana czterema liczbami kwantowymi: n, l, ml, ms. Dodanie poszczególnych wektorów momentu pędu umożliwia opisanie danego stanu atomu przez odpowiednie wartości wypadkowego krętu (momentu pędu) i jego składowej.
Wystarczy umieć znaleźć wartość wypadkowego krętu i jego rzutu dla
dwóch składowych, gdyż proces ten można będzie powtarzać dowolną
ilość razy. Bezwzględne wartości obu wektorów krętu orbitalnego
wynoszą:
Reasumując: jeżeli wartości własne kwadratów orbitalnych momentów pędów dwóch elektronów w atomie wynoszą odpowiednio: Ponieważ
każdy elektron posiada własny moment pędu (spin), więc w przypadku
atomu wieloelektronowego - obok wypadkowego krętu orbitalnego -
można mówić także o wypadkowym spinie całej powłoki elektronowej
atomu. Wartości wypadkowego spinu można łatwo otrzymać za pomocą
reguły dodawania krętów, którą stosowaliśmy poprzednio. Przez
Jeżeli atom posiada więcej niż jeden elektron, to dozwolone wartości całkowitego momentu pędu jego powłoki elektronowej można obliczyć wieloma sposobami, z których dwa zostaną omówione poniżej:
Dla każdej konfiguracji zarówno liczba składowych, jak i wartość całkowitego momentu pędu otrzymane tymi dwoma sposobami, są takie same. Nie znaczy to jednak, że oba te schematy są sobie równoważne także pod wszystkimi innymi względami. Okazuje się, że o tym, który z tych dwóch sposobów sumowania jest w danym przypadku bardziej uzasadniony, decydują wartości energii różnych typów oddziaływań w atomie.
Oddziaływanie magnetyczne między orbitalnym i spinowym momentem
magnetycznym pojedynczego elektronu znajdującego się w polu
centralnym daje się przedstawić w postaci wzoru
Oddziaływanie to nazywa się oddziaływaniem spin-orbita. Pełne obliczenia muszą uwzględniać również poprawki relatywistyczne. Równoczesne uwzględnienie w równaniu Schrödingera oddziaływania elektrostatycznego i spin-orbita jest zadaniem skomplikowanym, które znacznie się upraszcza, jeżeli jedno z tych oddziaływań można traktować jako znacznie mniejsze od drugiego. W związku z tym istnieją dwa krańcowe sposoby podejścia do zagadnienia atomu wieloelektronowego: 1) oddziaływanie elektrostatyczne dominuje nad oddziaływaniem spin-orbita - przybliżenie L-S; 2) oddziaływanie spin-orbita jest znacznie większe od niecentralnej części oddziaływania elektrostatycznego - przybliżenie sprzężenia j-j.
Oddziaływanie spin-orbita sprawia, że dobrą liczbą kwadratową staje
się całkowity moment pędu
Tak więc
w wyniku sprzężenia spin-orbita energia stanu kwantowego zależy
dodatkowo od liczby kwantowej J (w polu magnetycznym również
od
Z badań wynika, że sprzężenie Russella-Saundersa spotyka się przede wszystkim w atomach pierwiastków lekkich należących do pierwszych kolumn układu okresowego w niskich poziomach wzbudzenia, natomiast sprzężenie j-j występuje w widmach optycznych pierwiastków ciężkich grupujących się w dalszych kolumnach tego układu (także w widmach rentgenowskich), w szczególności w gazach szlachetnych w wyższych stanach wzbudzonych. góra |