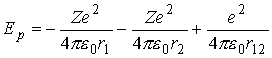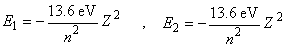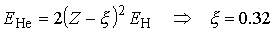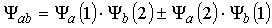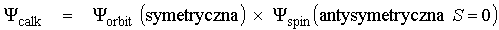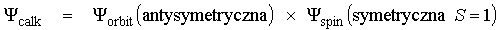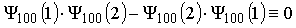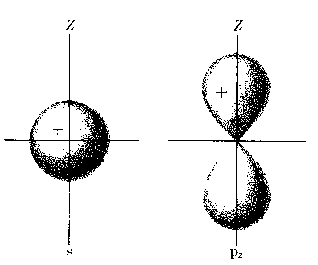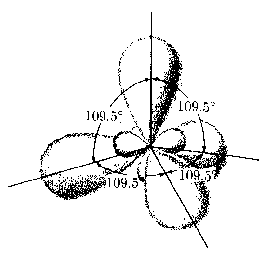idż do fizyka statystyczna. 2. Teoria Bohra układów wodoropodobnych.Doświadczenie Francka-Hertza. 3. Zjawisko fotoelektryczne. Wytwarzanie promieniowania rentgenowskiego. 4. Zjawisko Comptona. 5. Oddziaływanie promieniowania elektromagnetycznego z materią. 6. Fale de Broglie'a (własności, omówienie doświadczeń). 7. Postulaty fizyczne mechaniki kwantowej. Równanie Kleina - Gordona. 8. Mechanika falowa Schrödingera (operatory, postulaty). 9. Skok potencjału. Bariera potencjału. Zjawisko tunelowania. 10. Stany związane - nieskończona studnia potencjału. 11. Funkcje własne operatora pędu. Zasada nieoznaczoności. 12. Operator momentu pędu. 13. Równanie Schrödingera dla atomu wodoru; liczby kwantowe. Widma metali alkalicznych. 14. Orbitalny magnetyczny moment dipolowy. Precesja Larmora. 15. Oddziaływanie spin-orbita; sprzężenie L-S, j-j 16. Efekt Zeemana. Efekt Starka. 17. Konfiguracje elektronów w atomie. Reguły Hunda. 18. Liniowe widmo rentgenowskie. Prawo Moseley'a. Szerokość linii widmowej. 19. Atomy wieloelektronowe (helopodobne). Układ okresowy pierwiastków. 20. Molekuły dwuatomowe. Wiązania cząsteczkowe. Hybrydyzacja. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 19. Atomy wieloelektronowe (helopodobne). Układ okresowy pierwiastków.Atomy z dwoma elektronami ( helopodobne )
Można wprowadzić poprawkę na ekranowanie
- elektrony są identyczne i nierozróżnialne co możemy zapisać poprzez :
znak "+" daje funkcję symetryczną znak "-" daje funkcję antysymetryczną, wprowadzamy spin i spinowe funkcje falowe
Z zakazu Pauliego wynika, że całkowita funkcja falowa układu elektronów musi być antysymetryczna. Obowiązuje to dla wszystkich fermionów (cząstek o spinie ½). Możliwe są więc dwa przypadki: 1) 2) Dla helu :
przejście 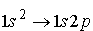 jest dozwolone
jest dozwoloneprzejście Stan 1s2s może być osiągnięty poprzez zderzenie atomów. Stan 1s2s jest stanem metastabilnym, gdyż trudno jest przejść atomowi do stanu niższego 1s2.
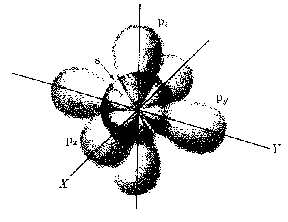
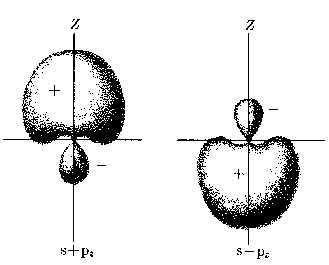
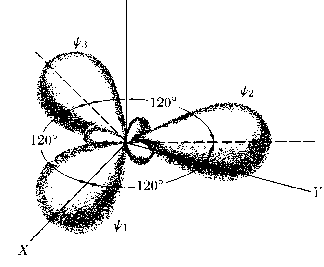
Atomy wieloelektronoweHybrydyzacja: jeżeli stany s i p mają w przybliżeniu takie same energie, dobrymi funkcjami falowymi są również kombinacje liniowe stanów s i p.
Wodór i metale alkaliczne - łatwo tracą elektron, który rozpoczyna nową powłokę, np.: 11Na = 1s2 2s2 2p6 3s1 Chlorowce - chętnie przyłączają elektron, który brakuje im do zamknięcia powłoki, np.: 17Cl = 1s2 2s2 2p6 3s2 3p5 Pierwiastki grup przejściowych tj.: 3d, 4d, 5d, 4f, i 5f mają nie zapełnione powłoki wewnętrzne d i f. Elektrony tych nie zapełnionych powłok odpowiedzialne są za właściwości magnetyczne tych pierwiastków. góra |
||||||||||